4月22日,深圳医院李欣团队联手中国人民大学龚新奇团队在《nature microbiology》上在线发表了题为“interferon-induced transmembrane protein-1 competitively blocks ephrin receptor a2-mediated epstein–barr virus entry into epithelial cells”的研究成果。这一突破性研究揭示了ifitm1通过关键氨基酸位点竞争性抑制ebv表面糖蛋白与上皮细胞感染受体epha2的结合,形成“钳形”竞争互作结构限制病毒的进入。ythdf3-ddx5通过表观调控ifitm1 mrna稳定性和表达水平控制着这一过程。深圳医院杨英桂副研究员为论文第一作者,博士生丁腾腾、硕士生丛瑛、博士后罗晓敏为论文并列第一作者。深圳医院李欣研究员、深圳医院郑清友主任医师、中国人民大学龚新奇教授、深圳医院吴丁兰副研究员为论文并列通讯作者。深圳医院是第一署名单位。

eb病毒(epstein-barr virus, ebv)是首个发现与人类肿瘤相关的疱疹病毒,感染全球90%以上的人口。在西方,50%以上感染者会发展成传染性单核细胞增多症,而在东方国家尤其是我国,ebv主要与霍奇金淋巴瘤、非霍奇金淋巴瘤、鼻咽癌、胃癌等恶性肿瘤密切相关。我国学者前期发现epha2是ebv侵入鼻咽上皮细胞的关键受体,但美国学者指出epha2高表达并非在所有情况下都会促进ebv感染,引发了科学界对是否存在其他潜在影响ebv感染的重要因素的关注。
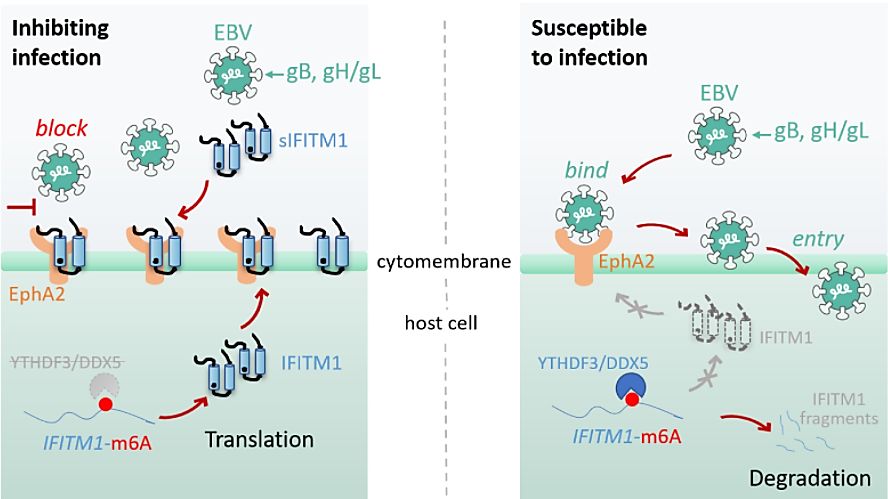
在该项目中,研究团队首先在鼻咽癌组织标本和ebv /-细胞系中观察到ifitm1与ebv感染存在潜在负相关性;在上皮细胞中,敲减细胞ifitm1的表达能在ebv病毒暴露的3h和72h时,分别观察到ebv拷贝数和病毒感染阳性细胞比率的增加,反之亦然。为了证实ifitm1对上皮细胞的保护作用,并为ifitm1未来临床转化与应用提供可能,研究人员将外源可溶性ifitm1(sifitm1)直接用于ebv暴露下的细胞及小鼠模型中,发现sifitm1能显著降低ebv感染上皮细胞的比率。
为了深入理解ifitm1抑制ebv感染的机制,研究团队探索发现ifitm1可内源和外源性地竞争性阻断上皮细胞受体epha2与ebv糖蛋白gh/gl和gb的结合,从而抑制病毒的侵入。3d蛋白质结构分析和相关实验证实,ifitm1在epha2和病毒糖蛋白之间形成了一种“钳形”的竞争性互动结构。ifitm1上的两个氨基酸残基(tyr112和leu104)对于抑制epha2与病毒糖蛋白结合发挥着至关重要的作用。这两个残基的突变直接削弱了ifitm1的抗病毒效能,并增强了epha2与病毒蛋白的结合力。

研究团队进一步发现ifitm1-mrna存在表观遗传修饰位点。ythdf3作为m6a甲基化修饰位点识别蛋白,与atp依赖性rna解旋酶家族成员ddx5形成互作,影响ifitm1 mrna的稳定性及表达水平,进而影响上皮细胞对ebv的易感性。
这项研究揭示了ifitm1在阻碍ebv侵入上皮细胞过程中扮演的关键角色以及背后的分子机制,加深了人们对ebv感染上皮细胞内在过程的理解,为基于ifitm1的更为广泛的病毒和疾病早期筛查、预防和治疗策略的拓展提供了全新思路,有望实现防控窗口的进一步前移。目前,研究团队已获得相关专利授权,正致力于研发新一代早筛和早防技术,以期有效对抗ebv和其它相关病毒引发的疾病。