n4-乙酰胞苷(ac4c)通常被认为是一种保守的、经过化学修饰的核苷,最早期首先被发现并证明存在于trna和rrna上,可以参与调控蛋白质合成过程中的编码准确性;另外,ac4c同样被发现存在于人类和酵母的mrna中,主要出现在编码序列上,通过改善mrna稳定性与其翻译效率从而调控靶基因表达。nat10作为组蛋白乙酰化转移酶gcn5相关nat(gnat)家族的成员,同时具有乙酰化酶结构域和rna结合结构域,被认为是一种可以在rrna、trna和mrna上催化ac4c修饰的酶。ac4c修饰可能与人类多种疾病的发生发展有关,包括炎症、代谢性疾病、自身免疫性疾病与肿瘤,但是其中机制尚未阐释十分清晰。
近期,南方医科大学深圳医院郭霞团队在advanced science(中科院一区top)期刊发表题为nat10/ac4c/foxp1 promotes malignant progression and facilitates immunosuppression by reprogramming glycolytic metabolism in cervical cancer(adv sci (weinh). 2023 oct 11:e2302705.)的原创性研究论文,揭示了nat10介导的ac4c修饰通过促进糖酵解作用,增强了调节性t(treg)细胞在宫颈癌免疫微环境(time)的浸润,并诱导了宫颈癌免疫抑制的发生,从而加速宫颈癌发展进程;通过抑制nat10可与抗pd-l1阻断治疗起到协同增效作用。南方医科大学深圳医院科技创新部郭霞教授、南方科技大学医学院张健教授、南方医科大学深圳医院临床医学创新中心李欣教授为该文的共同通讯作者,南方医科大学郭霞教授团队的硕士研究生陈晓娜为本文第一作者。

宫颈癌目前在中国是女性第二大常见的恶性肿瘤,也是女性癌症死亡的第四大原因。在过去的30年中,尽管早期宫颈癌的5年生存率在疫苗和早期筛查的的普及下明显提高,但是复发性或转移性宫颈癌患者预后仍然较差,5年生存率仅为17%。免疫检查点抑制剂治疗是近年来复发性或转移性宫颈癌中最突出的一类治疗方法,然而,据统计仅仅在大约15%的宫颈癌患者中发挥有效的治疗作用,抑制型免疫微环境不响应是其治疗失败的主要原因。
本研究中,作者团队通过临床组织样本、动物和细胞水平的一系列实验,从组织芯片分析、细胞功能实验和分子机制三个不同层面阐述了nat10介导的ac4c-rna修饰在宫颈癌进展中扮演的“促癌”的角色。从机制层面,通过atac-seq等发现转录因子hoxc8调控nat10基因表达调控增强是宫颈癌中nat10高表达的主要原因;通过acrip-seq、rna-seq和ribo-seq三者的联合分析第一次发现foxp1是宫颈癌细胞中nat10介导的ac4c乙酰化修饰的下游关键靶基因。作者进一步利用mrna稳定性实验、acrip-qpcr、nat10突变载体的构建等实验阐述了nat10通过ac4c依赖的方式使得foxp1的翻译效率增强,且发现了foxp1作为转录因子可激活glut4和khk的转录,最终导致宫颈癌细胞的糖酵解水平显著增加。
更重要的是,作者团队首次发现nat10介导的ac4c修饰所导致的宫颈癌细胞糖酵解增强、乳酸生成的增加促进了调节性t(treg)细胞在宫颈癌免疫微环境(time)的浸润,并诱导了宫颈癌免疫抑制的发生。并且,nat10敲低与抗pd-l1阻断治疗的协同作用,通过降低宫颈癌细胞的糖酵解水平,减少乳酸的产生,改善肿瘤微环境中的免疫抑制,最终起到协同增效抑制了肿瘤的进展。
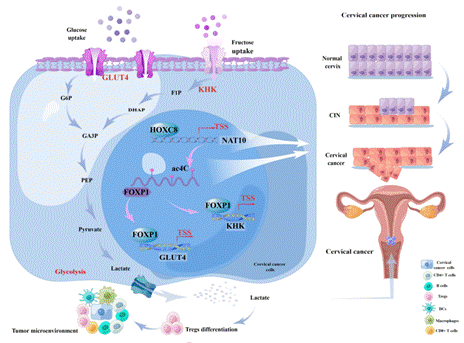
综上所述,这些发现揭示了nat10可作为宫颈癌进程中代谢和免疫联合治疗的潜在靶点,探索了抑制nat10和pd-l1免疫治疗在宫颈癌进展中的协同治疗作用,提示宫颈癌治疗中靶向新型ac4c修饰具有很好的应用前景,并对为未来以nat10为靶点的药物研发奠定了基础。